Презентація на тему «Электрический ток в жидкостях»

ПрезентацияНа тему: «Электрический ток в жидкостях»


Ток в жидкостях
Как известно, химически чистая (дистиллированная) вода является плохим проводником. Однако при растворении в воде различных веществ (кислот, щелочей, солей и др.) раствор становится проводником, из-за распада молекул вещества на ионы. Это явление называется электролитической диссоциацией, а сам раствор электролитом, способным проводить ток.
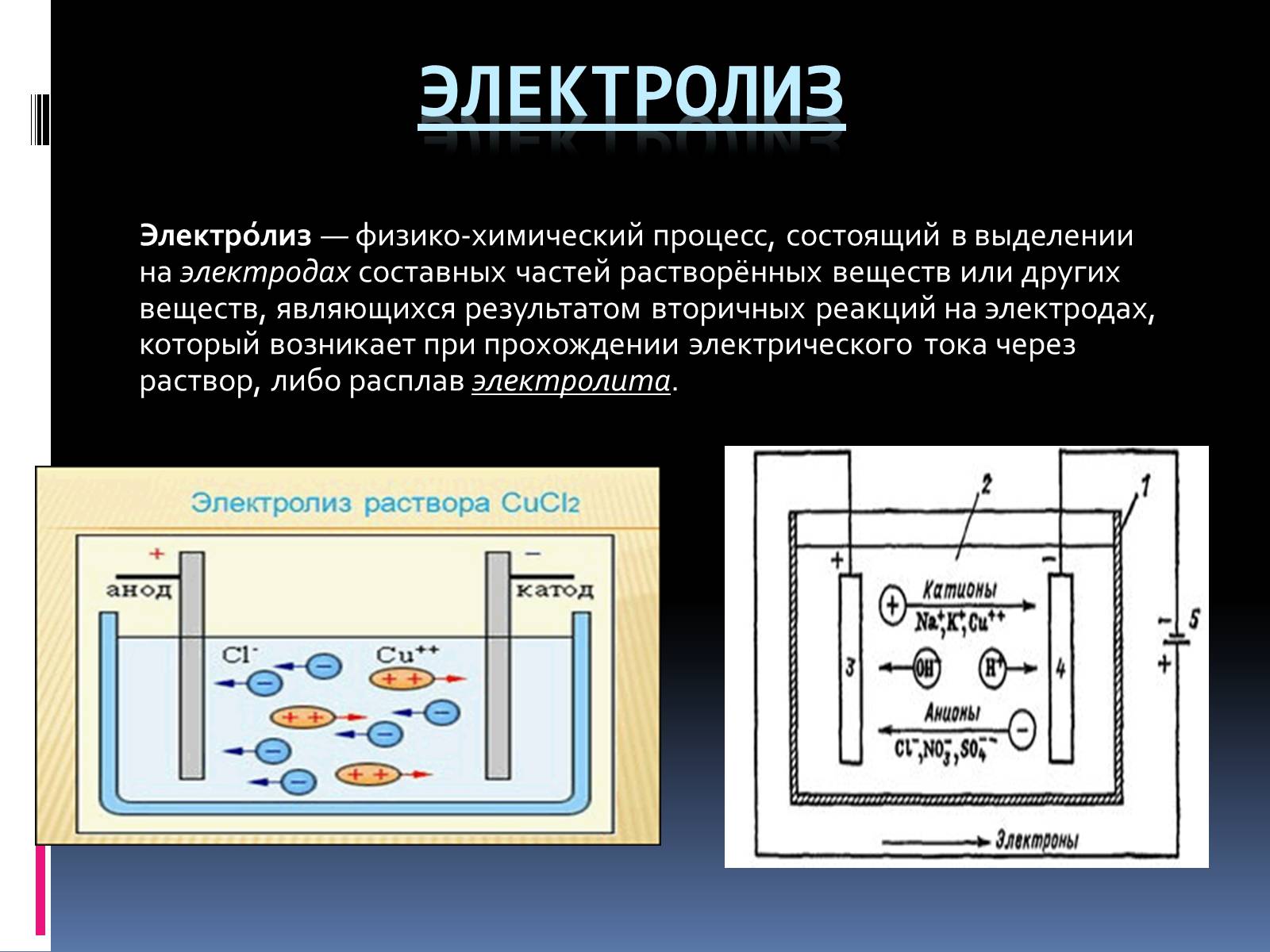
Электролиз
Электро́лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита.

Майкл Фарадей.
Майкл Фараде́й — английский физик-экспериментатор и химик. Член Лондонского королевского общества (1824) и множества других научных организаций, в том числе иностранный почётный член Петербургской академии наук (1830).
Открыл электромагнитную индукцию, лежащую в основе современного промышленного производства электричества и многих его применений. Создал первую модель электродвигателя. Среди других его открытий — первый трансформатор, химическое действие тока, законы электролиза, действие магнитного поля на свет, диамагнетизм. Первым предсказал электромагнитные волны[1]. Фарадей ввёл в научный обиход термины ион, катод, анод, электролит, диэлектрик, диамагнетизм, парамагнетизм и др. Также опубликовал в 1836 г. Законы электролиза, названные в последствии в его честь.

1-й Закона электролиза Фарадея-
Масса вещества, выделяющегося на каком-либо из электродов, прямо пропорциональна заряду, прошедшему через электролит
Электрохимический эквивалент вещества - табличная величина.

2-й Закон электролиза Фарадея-
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Протекание тока в жидкостях сопровождается выделением теплоты. При этом выполняется закон Джоуля-Ленца.

2-й Закон электролиза Фарадея-
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Протекание тока в жидкостях сопровождается выделением теплоты. При этом выполняется закон Джоуля-Ленца.

Электрическая диссоциация:
Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с растворителем; по данным спектроскопических методов, это взаимодействие носит в значительной мере химический характер. Наряду с сольватирующей способностью молекул растворителя определённую роль в электролитической диссоциации играет также макроскопическое свойство растворителя — его диэлектрическая проницаемость.

Презентацию подготовили ученики 11-А класса
Кожевников Богдан,Коваленко Влада.