Презентація на тему «Електрична провідність»

Електрична провідність в різних середовищах
Провідність металів. Провідність розчинів (розплавів) електролітів
Провідність металів
Провідність металів електронна (Рікке в 1901 р). Дослід з трьома полірованими і притиснутими циліндрами (мідна-алюмінієва-мідна) по яких протягом 1 року проходив електричний струм. Маси металів не змінилися.
1913 р. Мандельштам та Папалексі
1916 р. Стюарт та Томленсон
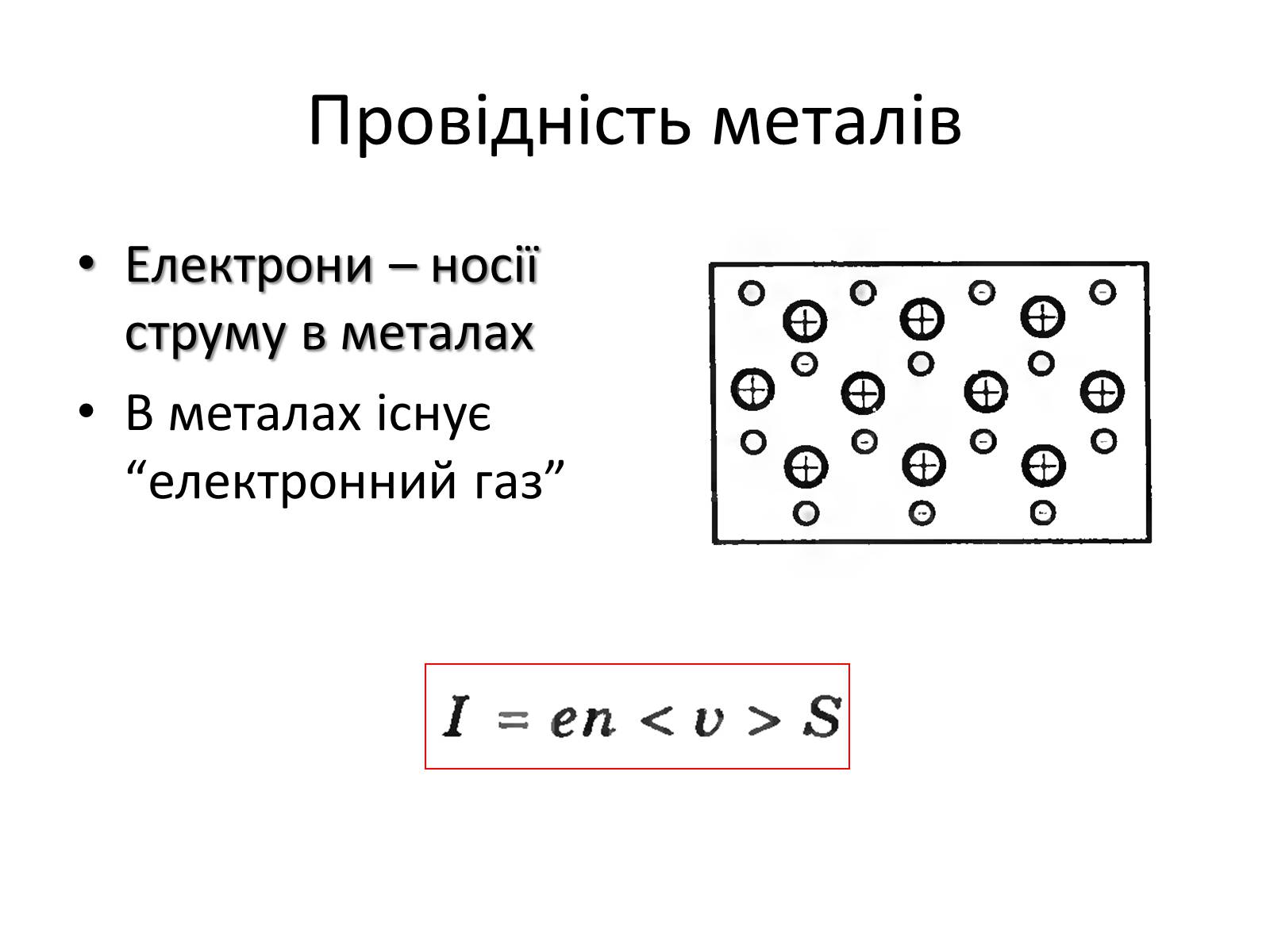
Провідність металів
Електрони – носії струму в металах
В металах існує “електронний газ”
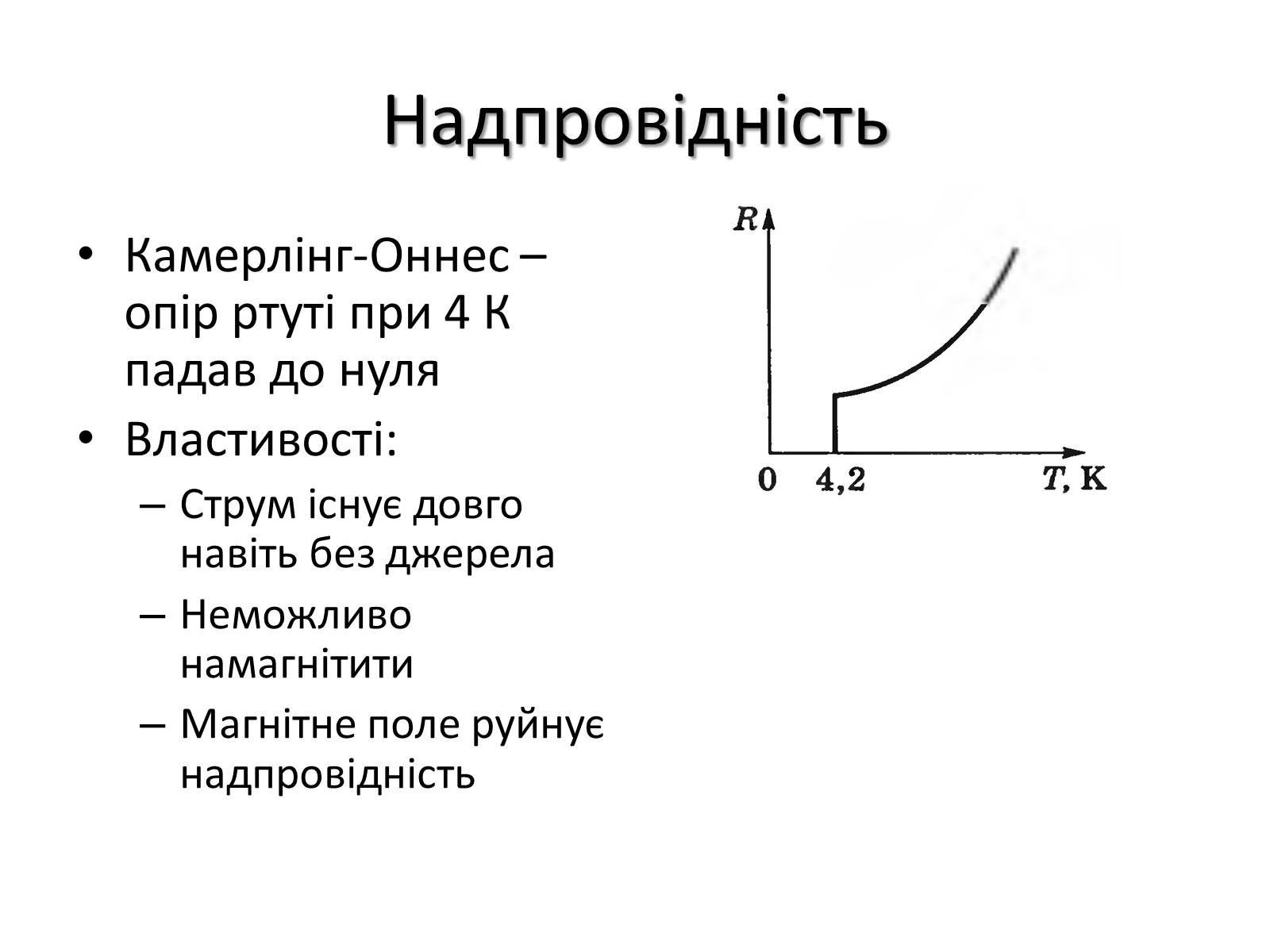
Надпровідність
Камерлінг-Оннес – опір ртуті при 4 К падав до нуля
Властивості:
Струм існує довго навіть без джерела
Неможливо намагнітити
Магнітне поле руйнує надпровідність

Провідність електролітів
Електроліти – розчини (розплави) електролітів, лугів, солей
Електролітична дисоціація на іони – розпад речовини на іони під дією молекул розчинника
Зворотній процес до дисоціації – молізація (рекомбінація)
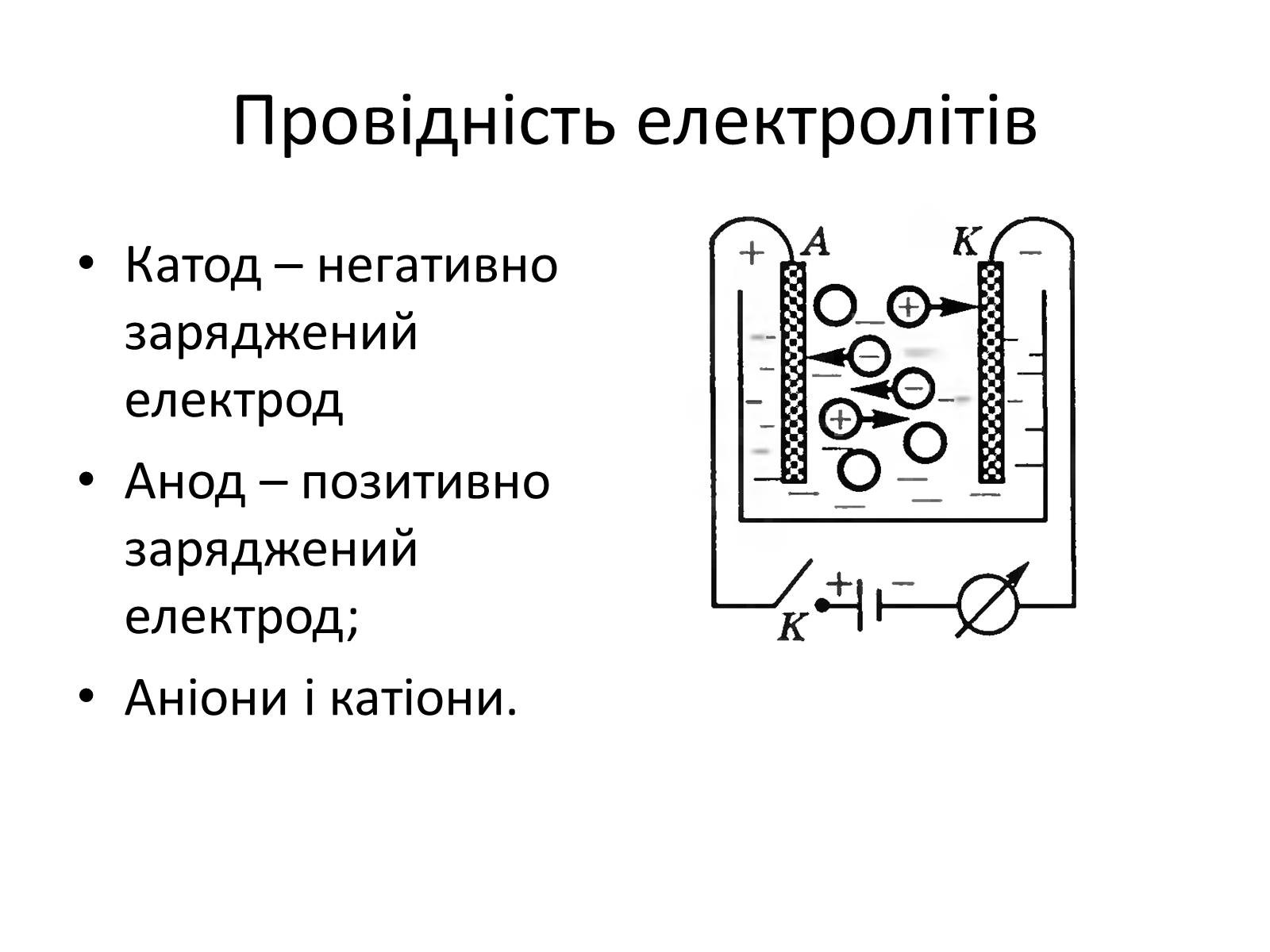
Провідність електролітів
Катод – негативно заряджений електрод
Анод – позитивно заряджений електрод;
Аніони і катіони.

Провідність електролітів
Носіями електричного струму в електролітах є позитивно та негативно заряджені іони. Протікання струму супроводжується перенесенням речовини (окислювально-відновлювальні реакції)
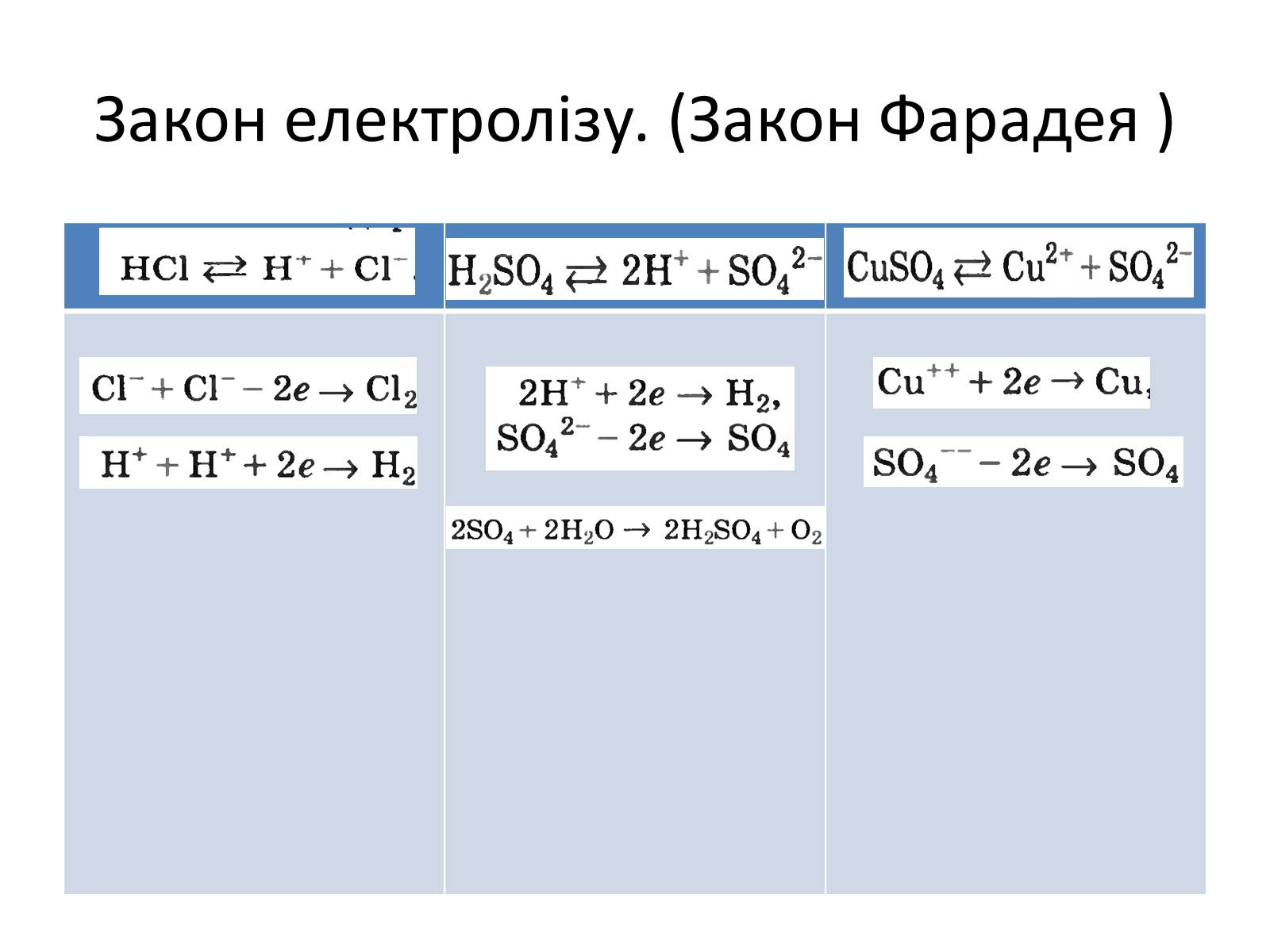
Закон електролізу. (Закон Фарадея )
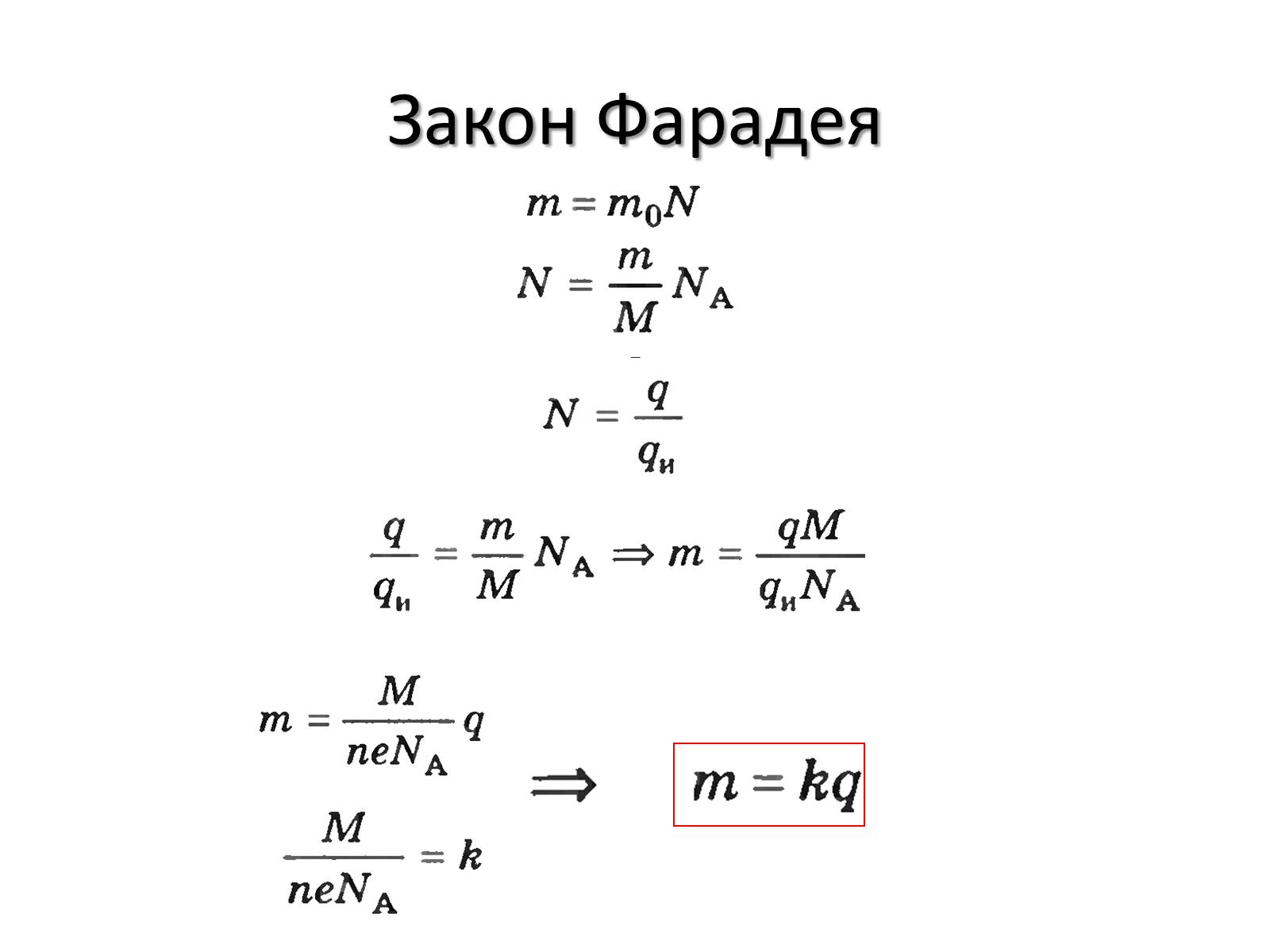
Закон Фарадея
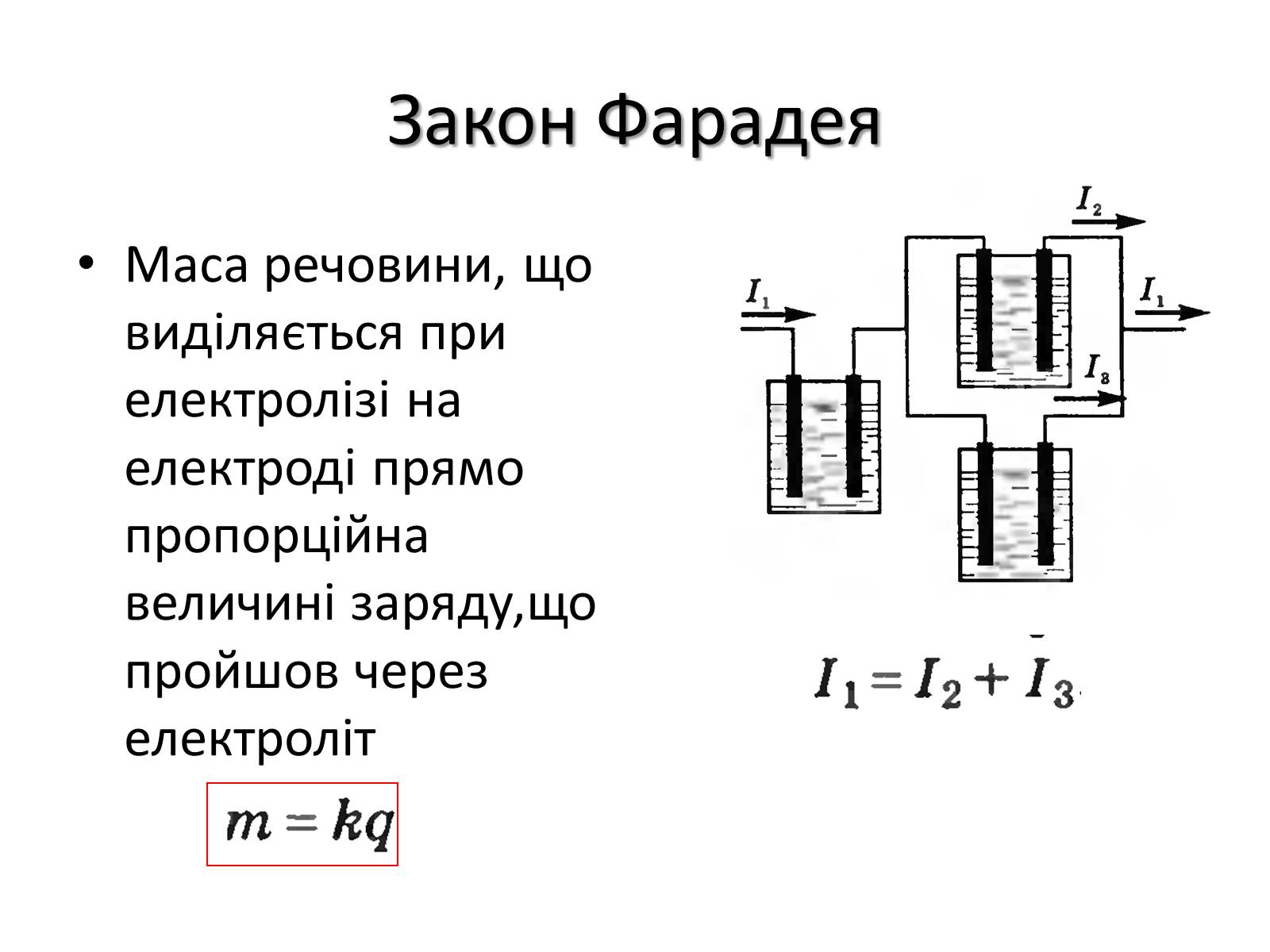
Закон Фарадея
Маса речовини, що виділяється при електролізі на електроді прямо пропорційна величині заряду,що пройшов через електроліт

Застосування електролізу
Очищення або рафінування металів
Електрометалургія – видобуток металів з руди
Гальваностегія – покриття металу іншим металом
Гальванопластика – виготовлення металічних форм (шаблонів)