Презентація на тему «Амінокислоти. Історія їх відкриття»

Амінокислоти. Історія їх відкриття.
Виконали : л-ст Капуста Є.С.
л-ст Гаврилюк С.А.

Історія відкриття.
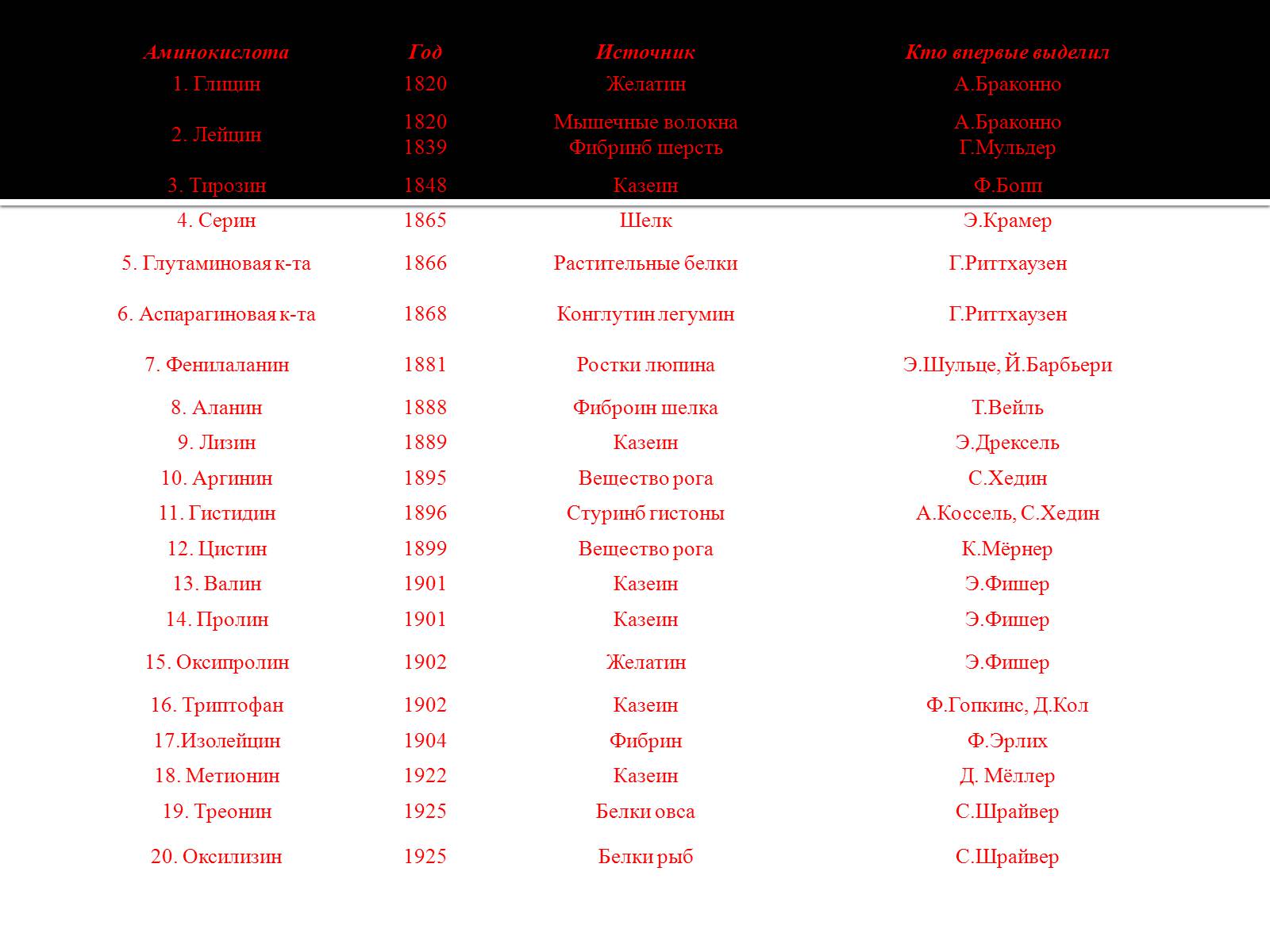
До початку XIX століття з'являються перші роботи по хімічному вивченню білків. Вже в 1803 р. Дж. Дальтон дає перші формули білків - альбуміну і желатину - як речовин, що містять азот. У 1810 р. Ж. Гей -Люссак проводить хімічні аналізи білків - фібрину крові , казеїну і відзначає подібність їх елементного складу. Вирішальне значення для розуміння хімічної природи білків мало виділення при їх гідролізі амінокислот. Ймовірно , першим це зробив А. Браконно в 1820 р., коли , діючи на білки сірчаної кислотою , при кип'ятінні він отримав « клейовий цукор» , або глікокол ( гліцин ) , при гідролізі фібрину з м'яса - лейцин і при розкладанні вовни - також лейцин і суміш інших продуктів гідролізу . Першою відкритою амінокислотою був , мабуть , аспарагін , виділений Л. Вокленом з соку спаржі Asparagus ( 1806). В цей же час Ж. Пруст отримав лейцин при розкладанні сиру і сиру. Потім з продуктів гідролізу білка були виділені багато інших амінокислоти
(табл. 1 ) .
Аминокислота
Год
Источник
Кто впервые выделил
1. Глицин
1820
Желатин
А.Браконно
2. Лейцин
1820
1839
Мышечные волокна
Фибринб шерсть
А.Браконно
Г.Мульдер
3. Тирозин
1848
Казеин
Ф.Бопп
4. Серин
1865
Шелк
Э.Крамер
5. Глутаминовая к-та
1866
Растительные белки
Г.Риттхаузен
6. Аспарагиновая к-та
1868
Конглутин легумин
Г.Риттхаузен
7. Фенилаланин
1881
Ростки люпина
Э.Шульце, Й.Барбьери
8. Аланин
1888
Фиброин шелка
Т.Вейль
9. Лизин
1889
Казеин
Э.Дрексель
10. Аргинин
1895
Вещество рога
С.Хедин
11. Гистидин
1896
Стуринб гистоны
А.Коссель, С.Хедин
12. Цистин
1899
Вещество рога
К.Мёрнер
13. Валин
1901
Казеин
Э.Фишер
14. Пролин
1901
Казеин
Э.Фишер
15. Оксипролин
1902
Желатин
Э.Фишер
16. Триптофан
1902
Казеин
Ф.Гопкинс, Д.Кол
17.Изолейцин
1904
Фибрин
Ф.Эрлих
18. Метионин
1922
Казеин
Д. Мёллер
19. Треонин
1925
Белки овса
С.Шрайвер
20. Оксилизин
1925
Белки рыб
С.Шрайвер

Перша концепція будівлі білків належить голландському хіміку Г. Мульдером (1836). Грунтуючись на теорії радикалів, він сформулював поняття про мінімальну структурну одиницю, що входить до складу всіх білків. Цю одиницю, якою приписувався склад 2C8H12N2 + 50, Г. Мульдер назвав протеїном (Рг), а свою концепцію - теорією протеїну.
Пізніше склад протеїну був уточнений - C40H62N10O12 ; додатково до протеїну одиницям деякі білки містили сірку і фосфор. Формула білків , запропонована Мульдером в 1838 р. , виглядала так:
Г. Мульдер користувався структурними формулами і для позначення ряду фізіологічних процесів. У своєму підручнику фізіологічної хімії (1844) він розглядав дихання як окислення протеїну , травлення - як перебудову білка з зміною змісту S , Р , Са і т. п.
Роботи Г. Мульдера сприяли широкому поширенню поглядів про єдність всіх білків , їх фундаментальному значенні в світі живої природи.
Однак незабаром настають важкі часи для теорії протеїну. У 1846 р. Н. Е. Лясковський , який працював у лабораторії Ю. Лібіха , довів неточність багатьох наведених Г. Мульдером аналізів. Свої сумніви у правильності теорії публічно висловив Ю. Лібіх . Г. Мульдер намагався коригувати формулу протеїну , але зрештою поступився під натиском нових фактів і відкриттів.
Структура і властивості амінокислот
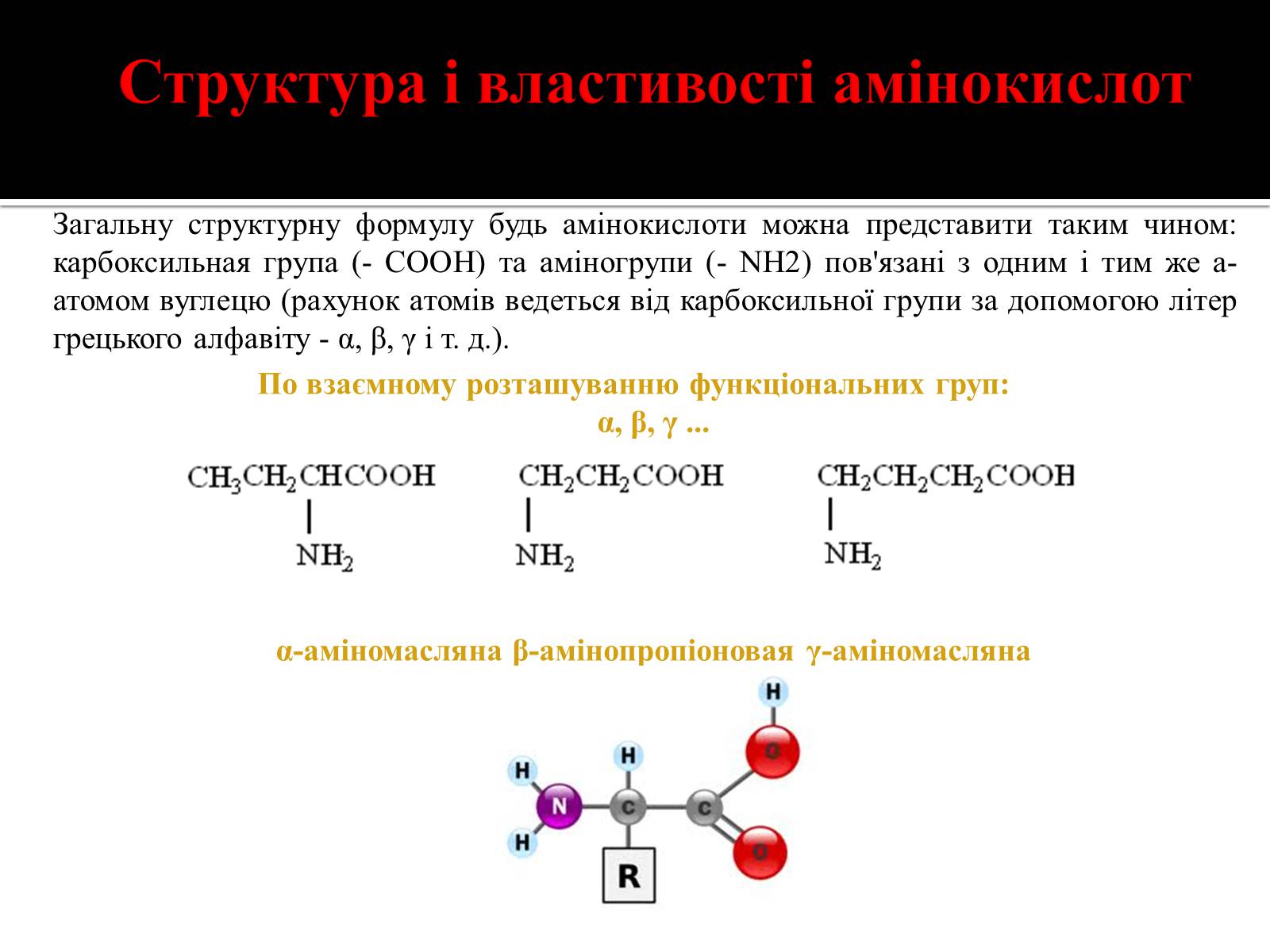
Загальну структурну формулу будь амінокислоти можна представити таким чином: карбоксильная група (- СООН) та аміногрупи (- NH2) пов'язані з одним і тим же a-атомом вуглецю (рахунок атомів ведеться від карбоксильної групи за допомогою літер грецького алфавіту - α, β, γ і т. д.).
По взаємному розташуванню функціональних груп:
α, β, γ ...
α-аміномасляна β-амінопропіоновая γ-аміномасляна

Класифікація
По радикалу
Не полярні: гліцин, аланін, валін, ізолейцин, лейцин, пролін, метіонін,
фенілаланін, триптофан
Полярні незаряджені (заряди скомпенсовані) pH = 7: серин, треонін, цистеїн, аспарагін, глутамін, тирозин
Полярні заряджені негативно при pH <7: аспартат, глутамат
Полярні заряджені позитивно при pH> 7: лізин, аргінін, гістидин
За функціональним групам
аліфатичні
Моноаміномонокарбоновие : гліцин , аланін , валін , ізолейцин , лейцин
Оксімоноамінокарбоновие : серин , треонін
Моноамінодікарбоновие : аспартат , глутамат , за рахунок другої карбоксильної групи несуть в розчині негативний заряд
Аміди моноамінодікарбонових : аспарагін , глутамін
Діаміномонокарбоновие : лізин , аргінін , несуть в розчині позитивний заряд
Серосодержащіе : цистеїн , метіонін
Ароматичні : фенілаланін , тирозин , триптофан , ( гістидин )
Гетероциклічні : триптофан , гістидин , пролін
Імінокіслоти : пролін

7
Незамінні амінокислоти
Незамінними називаються амінокислоти, які не можуть бути синтезовані організмом з речовин, що надходять з їжею, в кількостях, достатніх для того, щоб задовольнити фізіологічні потреби організму.
7
Незамінні амінокислоти
Незамінними називаються амінокислоти, які не можуть бути синтезовані організмом з речовин, що надходять з їжею, в кількостях, достатніх для того, щоб задовольнити фізіологічні потреби організму.
Оптична ізомерія
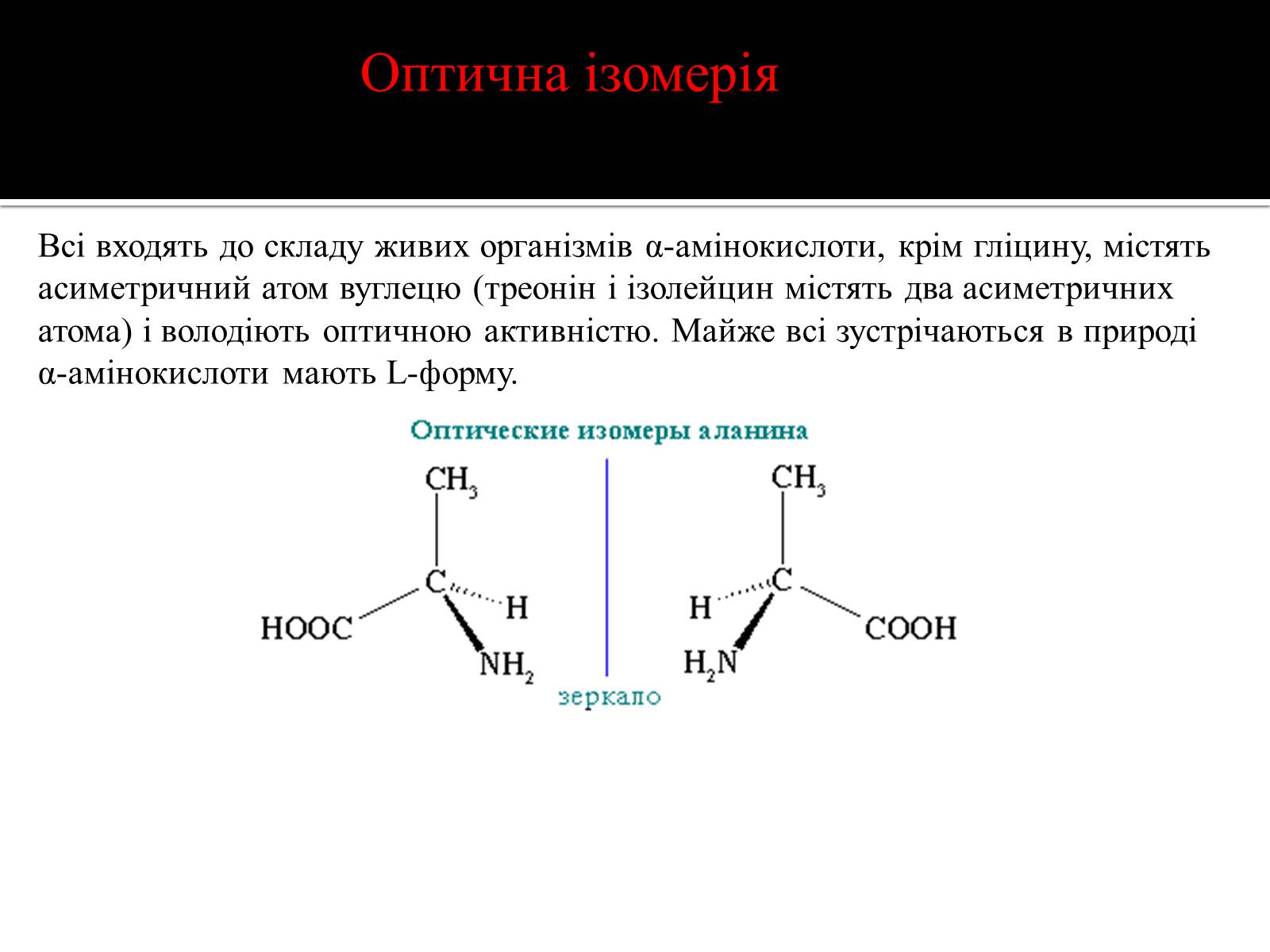
Всі входять до складу живих організмів α-амінокислоти, крім гліцину, містять асиметричний атом вуглецю (треонін і ізолейцин містять два асиметричних атома) і володіють оптичною активністю. Майже всі зустрічаються в природі α-амінокислоти мають L-форму.

Свойства аминокислот
Амінокислоти - безбарвні кристалічні речовини, добре розчинні у воді. Багато хто з них мають солодкий смак.
Всі амінокислоти амфотерні сполуки, вони можуть виявляти як кислотні властивості, обумовлені наявністю в їх молекулах карбоксильної групи-COOH, так і основні властивості, обумовлені аминогруппой-NH2. Амінокислоти взаємодіють з кислотами і лугами.
Амінокислоти зазвичай можуть вступати в усі реакції, характерні для карбонових кислот і амінів.
Ізоелектричної точкою амінокислоти називають значення pH, при якому максимальна частка молекул амінокислоти володіє нульовим зарядом. При такому pH амінокислота найменш рухлива в електричному полі, і дане властивість можна використовувати для розділення амінокислот, а також білків і пептидів.
11
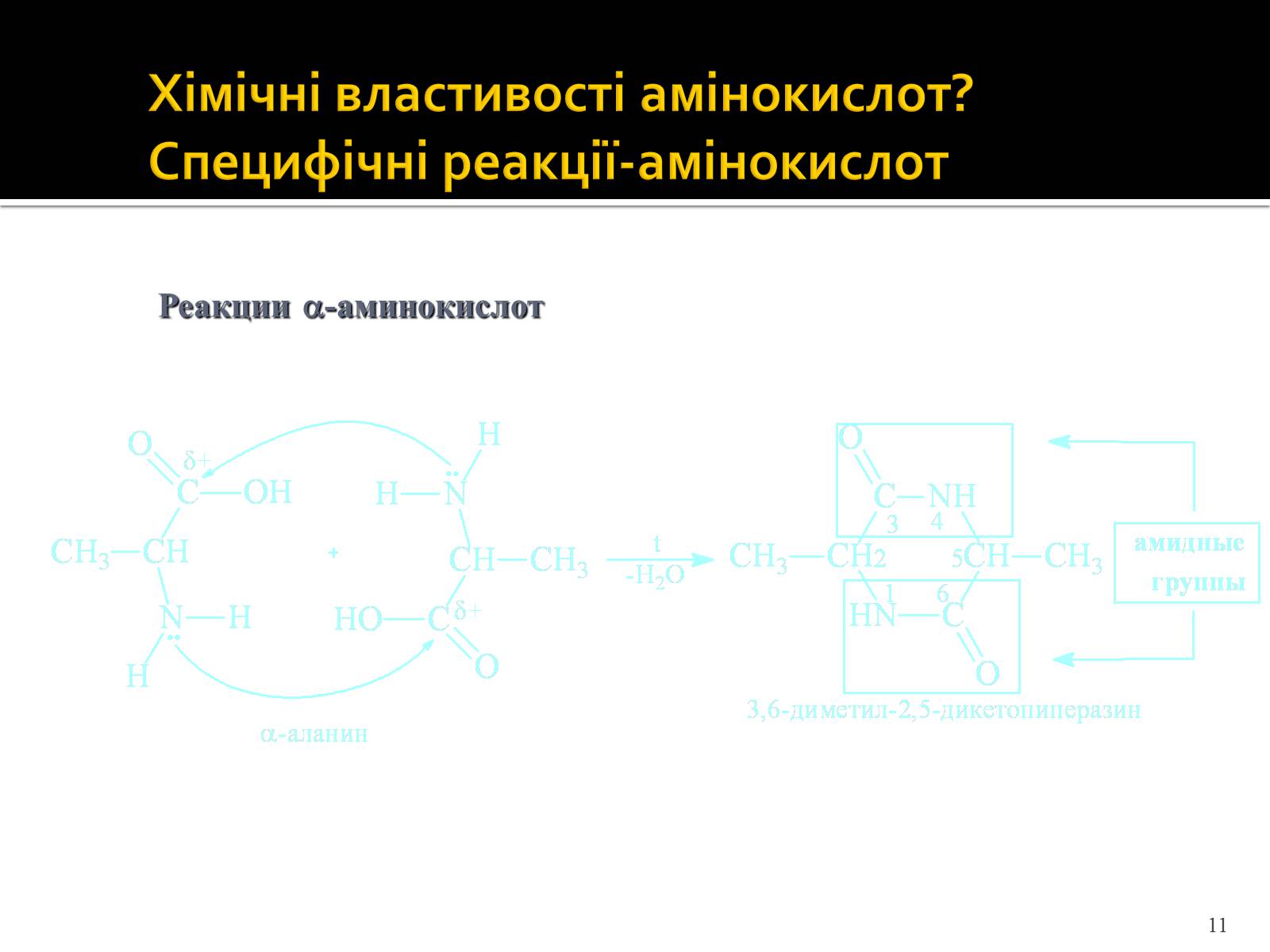
Хімічні властивості амінокислот? Специфічні реакції-амінокислот
Реакции -аминокислот

Способи отримання
Лабораторний
Промисловий
оцтова кислота → хлоруксусная кислота → амінооцтова кислота
СН3-СООН + Сl2 → СН2-СООН
|
Cl
СН2-СООН + NH3 → СН2-СООН
| |
Сl NH2
Гідроліз білків
13
Способи отримання амінокислот Біологічний спосіб отримання амінокислот
Корм з добавкою рацемической сумішіa-амінокислот
Відходи з оптично активним ізомером? A-амінокислоти
Очищення
Оптично чистий ізомерa-аминокислоты

Використання амінокислот
Амінокислоти знаходять широке застосування в якості харчових добавок.Наприклад, на лізин, триптофан, треонін і метіоніном збагачують кормисільськогосподарських тварин, додавання натрієвої солі глутамінової кислоти (глутамату натрію) надає ряду продуктів м'ясний смак.

У живих організмах:
Природні амінокислоти (близько 150)
Протеїногенні амінокислоти (близько 20) в білках
Незамінні:
валін, лейцин, лізин, треонін, цистеїн та ін
Антибіотики (пеніцилін)
Поліамідні смоли (капрон, нейлон)
* Добавка до корму

У суміші або окремо амінокислоти застосовують у медицині, у тому числі при порушеннях обміну речовин і захворюваннях органів травлення, при деяких захворюваннях центральної нервової системи (γ-аміномасляна і глутамінова кислоти, ДОФА).
Амінокислоти використовуються при виготовленні лікарських препаратів , барвників , в парфумерної промисловості , у виробництві миючих засобів , синтетичних волокон і плівки і т. д.
Для господарських та медичних потреб амінокислоти отримують за допомогою мікроорганізмів шляхом так званого мікробіологічного синтезу (лізин , триптофан , треонін ) ; їх виділяють також з гідролізатів природних білків ( пролін , цистеїн , аргінін , гістидин ) . Але найбільш перспективні змішані способи отримання , що суміщають методи хімічного синтезу та іспользованіеферментов.

Спасибі за увагу!